 加载中...
加载中...
 日期:2022-11-15
日期:2022-11-15
 肌腱病是一种举行性肌肉骨骼疾病,其特性是肌腱的炎症以及退行性变化,致使痛苦悲伤、肿胀以及功效受损,然而今朝仍缺少有用的医治要领。于肌腱病以及其他疾病的肇始以及进展历程中,各类亚型的免疫细胞于炎症级联反映中阐扬着要害作用。而于这些免疫细胞中,巨噬细胞可以或许浸润受损的肌腱,调治局部炎症及愈合历程。巨噬细胞的表型包孕M1以及M2表型,此中M1巨噬细胞浸润至毁伤部位,开释各类倒霉在构造修复的促炎细胞因子,而M2巨噬细胞可以或许介入后期的愈合历程,具备断根细胞内病原体以及促成肌腱再生的能力。基在此,调治巨噬细胞的异质性多是医治肌腱病变的一种有用医治路子。最近几年来,干细胞源性的小细胞外囊泡于各类疾病中的医治作用获得广泛的存眷。2020年,上海交通年夜学从属第六人平易近病院汪泱传授团队在J Extracell Vesicles揭晓的“Human ESC-sEVs alleviate age-related bone loss by rejuvenating senescent bone marrow-derived mesenchymal stem cells”文章中,发明胚胎干细胞源性细胞外囊泡中含有多种年青化因子卵白身分,并可以或许促成朽迈小鼠骨髓间充质干细胞年青化。此外,今朝已经有多项研究证明了sEVs医治肌腱病变的潜于机制。值患上存眷的是,一些针对于成体干细胞衍生的年夜细胞外囊泡的研究注解,lEVs可能实现与sEVs近似的医治功效,而干细胞衍生的lEVs是否可以或许有用医治肌腱病变尚不清晰。2022年8月,汪泱传授团队于细胞外囊泡的研究中再次得到冲破,在Bioactive Materials揭晓了题为“Large extracellular vesicles secreted by human iPSC-derived MSCs ameliorate tendinopathy via regulating macrophage heterogeneity“文章。文章研究了引诱性多能干细胞来历的间充质干细胞排泄的lEVs (iMSC-lEVs)于肌腱病变中的医治作用和iMSC-lEVs于体外对于巨噬细胞极化的调治作用。经由过程外泌体卵白质组学、RNA测序、卵白免疫印迹等技能要领,研究注解iMSC-lEVs可以或许部门经由过程DUSP2以及DUSP3来介导p38 MAPK旌旗灯号通路,并使M1巨噬细胞向M2巨噬细胞举行极化改变,从而减轻肌腱病变中的痛苦悲伤以及炎症。此中,中科新生命为该研究提供了细胞外囊泡卵白质组学办事。
肌腱病是一种举行性肌肉骨骼疾病,其特性是肌腱的炎症以及退行性变化,致使痛苦悲伤、肿胀以及功效受损,然而今朝仍缺少有用的医治要领。于肌腱病以及其他疾病的肇始以及进展历程中,各类亚型的免疫细胞于炎症级联反映中阐扬着要害作用。而于这些免疫细胞中,巨噬细胞可以或许浸润受损的肌腱,调治局部炎症及愈合历程。巨噬细胞的表型包孕M1以及M2表型,此中M1巨噬细胞浸润至毁伤部位,开释各类倒霉在构造修复的促炎细胞因子,而M2巨噬细胞可以或许介入后期的愈合历程,具备断根细胞内病原体以及促成肌腱再生的能力。基在此,调治巨噬细胞的异质性多是医治肌腱病变的一种有用医治路子。最近几年来,干细胞源性的小细胞外囊泡于各类疾病中的医治作用获得广泛的存眷。2020年,上海交通年夜学从属第六人平易近病院汪泱传授团队在J Extracell Vesicles揭晓的“Human ESC-sEVs alleviate age-related bone loss by rejuvenating senescent bone marrow-derived mesenchymal stem cells”文章中,发明胚胎干细胞源性细胞外囊泡中含有多种年青化因子卵白身分,并可以或许促成朽迈小鼠骨髓间充质干细胞年青化。此外,今朝已经有多项研究证明了sEVs医治肌腱病变的潜于机制。值患上存眷的是,一些针对于成体干细胞衍生的年夜细胞外囊泡的研究注解,lEVs可能实现与sEVs近似的医治功效,而干细胞衍生的lEVs是否可以或许有用医治肌腱病变尚不清晰。2022年8月,汪泱传授团队于细胞外囊泡的研究中再次得到冲破,在Bioactive Materials揭晓了题为“Large extracellular vesicles secreted by human iPSC-derived MSCs ameliorate tendinopathy via regulating macrophage heterogeneity“文章。文章研究了引诱性多能干细胞来历的间充质干细胞排泄的lEVs (iMSC-lEVs)于肌腱病变中的医治作用和iMSC-lEVs于体外对于巨噬细胞极化的调治作用。经由过程外泌体卵白质组学、RNA测序、卵白免疫印迹等技能要领,研究注解iMSC-lEVs可以或许部门经由过程DUSP2以及DUSP3来介导p38 MAPK旌旗灯号通路,并使M1巨噬细胞向M2巨噬细胞举行极化改变,从而减轻肌腱病变中的痛苦悲伤以及炎症。此中,中科新生命为该研究提供了细胞外囊泡卵白质组学办事。
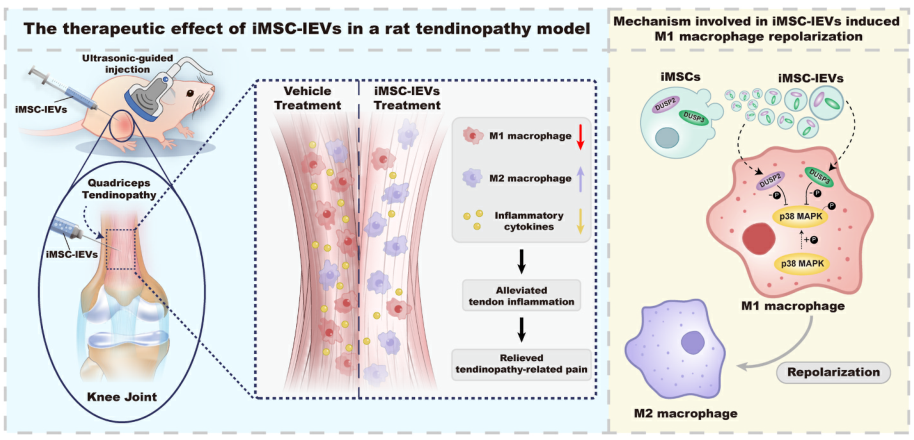 iMSC-lEVs于活体肌腱病变模子中的医治机制及巨噬细胞复极调治机制示用意研究质料iMSC-lEVs;iMSC-sEVs;小鼠巨噬细胞细胞系RAW 264.7;年夜鼠肌腱病变模子;肌腱病患者肌腱构造技能线路iMSC-sEVs以及iMSC-lEVs的分散与表征;成立年夜鼠肌腱病模子,并于体内评估iMSC-lEVs的镇痛作用;接纳RAW 264.7细胞,研究iMSC-lEVs对于巨噬细胞极化的调治作用;RNA-seq要领探究iMSC-lEVs调治巨噬细胞表型转变的机制;对于iMSC-lEVs举行卵白质组学阐发以确定其调控通路的上游卵白;研究iMSC-lEVs对于肌腱病患者肌腱构造的作用。研究成果iMSC-sEVs以及iMSC-lEVs的分散与表征研究职员接纳引诱性多能干细胞来历的间充质干细胞(iMSCs)作为sEVs以及lEVs的孕育发生源。哄骗差速离心分散法从iMSCs造就基中分散并网络iMSC-sEVs (100 nm摆布)以及iMSC-lEVs (200nm以上),并经由过程透射电镜、Western blot、NTA粒径阐发对于iMSC-sEVs与iMSC-lEVs举行表征。
iMSC-lEVs于活体肌腱病变模子中的医治机制及巨噬细胞复极调治机制示用意研究质料iMSC-lEVs;iMSC-sEVs;小鼠巨噬细胞细胞系RAW 264.7;年夜鼠肌腱病变模子;肌腱病患者肌腱构造技能线路iMSC-sEVs以及iMSC-lEVs的分散与表征;成立年夜鼠肌腱病模子,并于体内评估iMSC-lEVs的镇痛作用;接纳RAW 264.7细胞,研究iMSC-lEVs对于巨噬细胞极化的调治作用;RNA-seq要领探究iMSC-lEVs调治巨噬细胞表型转变的机制;对于iMSC-lEVs举行卵白质组学阐发以确定其调控通路的上游卵白;研究iMSC-lEVs对于肌腱病患者肌腱构造的作用。研究成果iMSC-sEVs以及iMSC-lEVs的分散与表征研究职员接纳引诱性多能干细胞来历的间充质干细胞(iMSCs)作为sEVs以及lEVs的孕育发生源。哄骗差速离心分散法从iMSCs造就基中分散并网络iMSC-sEVs (100 nm摆布)以及iMSC-lEVs (200nm以上),并经由过程透射电镜、Western blot、NTA粒径阐发对于iMSC-sEVs与iMSC-lEVs举行表征。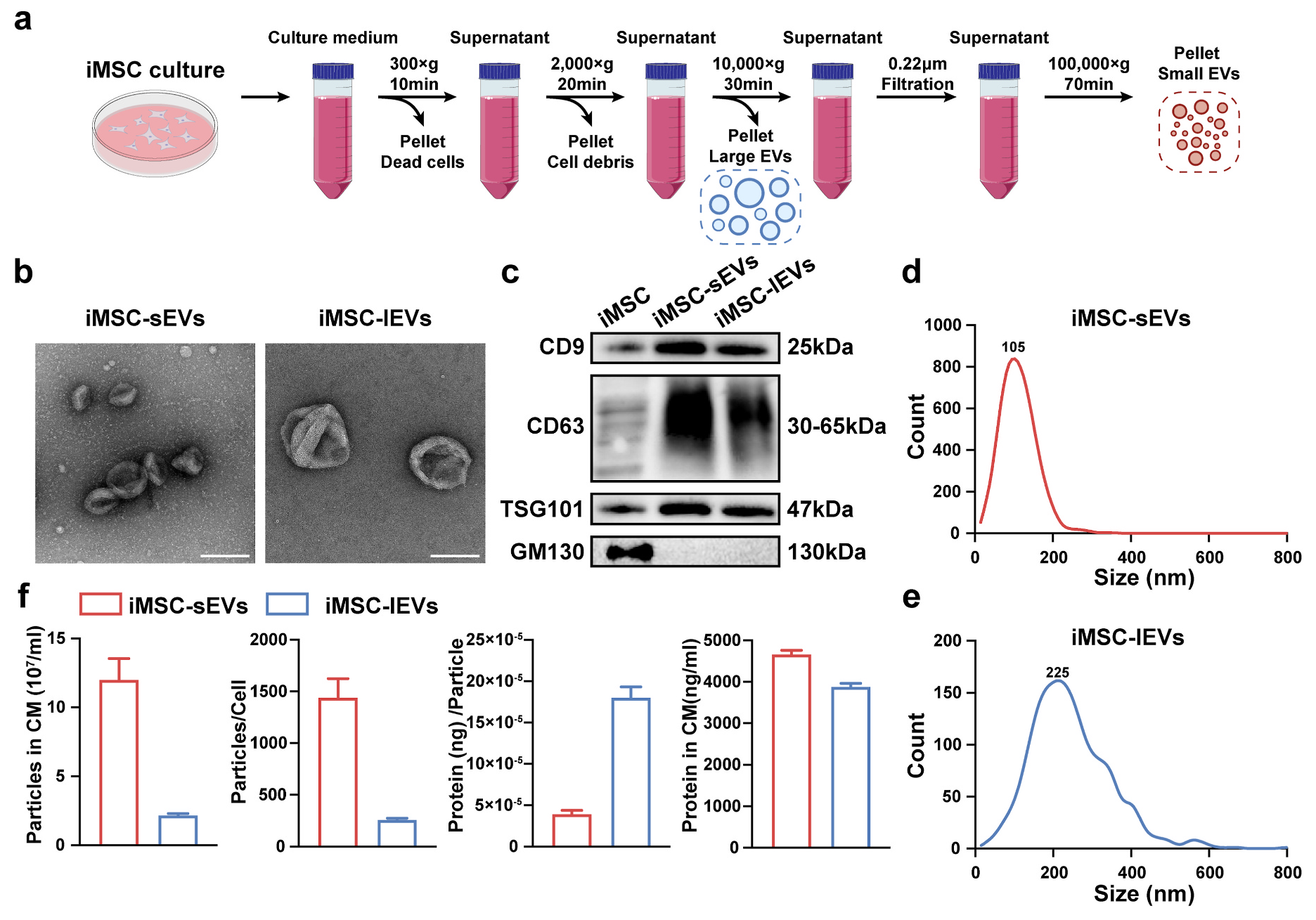 图1 iMSC-sEVs and iMSC-lEVs的分散与表征图2. iMSC-lEVs可减轻肌腱病相干痛苦悲伤并削减体内炎症研究职员起首成立了年夜鼠肌腱病模子,并于体内评估iMSC-lEVs的镇痛作用。每一周以100 μL lEVs剂量医治肌腱病变年夜鼠,与此同时于统一时间点以100 μL sEVs剂量举行比力医治。接纳静态痛苦悲伤相干举动阐发及步态阐发对于年夜鼠举行痛苦悲伤评估,成果注解,于医治4周后,运用lEVs可以或许减轻肌腱病变年夜鼠的痛苦悲伤并显著改良肌腱病变年夜鼠的动态行走模式。值患上一提,成果注解lEVs医治具备与sEVs相似的镇痛功效。此外,HE染色成果显示,于医治4周后lEVs促成了肌腱病变中的肌腱修复。接下来研究职员研究了lEVs对于巨噬细胞表型浸润的影响。 IHC染色成果显示,于医治2周以及4周后,lEVs医治削减M1巨噬细胞的浸润,并促成M2巨噬细胞的浸润,且lEVs组与sEVs组无显著差异。免疫组化染色显示,医治2周以及4周后,lEVs以及sEVs医治均显著降低促炎因子的表达。这些数据注解,lEVs医治于年夜鼠肌腱病变模子中具备抗炎以及镇痛作用,且与sEVs的能力相似。
图1 iMSC-sEVs and iMSC-lEVs的分散与表征图2. iMSC-lEVs可减轻肌腱病相干痛苦悲伤并削减体内炎症研究职员起首成立了年夜鼠肌腱病模子,并于体内评估iMSC-lEVs的镇痛作用。每一周以100 μL lEVs剂量医治肌腱病变年夜鼠,与此同时于统一时间点以100 μL sEVs剂量举行比力医治。接纳静态痛苦悲伤相干举动阐发及步态阐发对于年夜鼠举行痛苦悲伤评估,成果注解,于医治4周后,运用lEVs可以或许减轻肌腱病变年夜鼠的痛苦悲伤并显著改良肌腱病变年夜鼠的动态行走模式。值患上一提,成果注解lEVs医治具备与sEVs相似的镇痛功效。此外,HE染色成果显示,于医治4周后lEVs促成了肌腱病变中的肌腱修复。接下来研究职员研究了lEVs对于巨噬细胞表型浸润的影响。 IHC染色成果显示,于医治2周以及4周后,lEVs医治削减M1巨噬细胞的浸润,并促成M2巨噬细胞的浸润,且lEVs组与sEVs组无显著差异。免疫组化染色显示,医治2周以及4周后,lEVs以及sEVs医治均显著降低促炎因子的表达。这些数据注解,lEVs医治于年夜鼠肌腱病变模子中具备抗炎以及镇痛作用,且与sEVs的能力相似。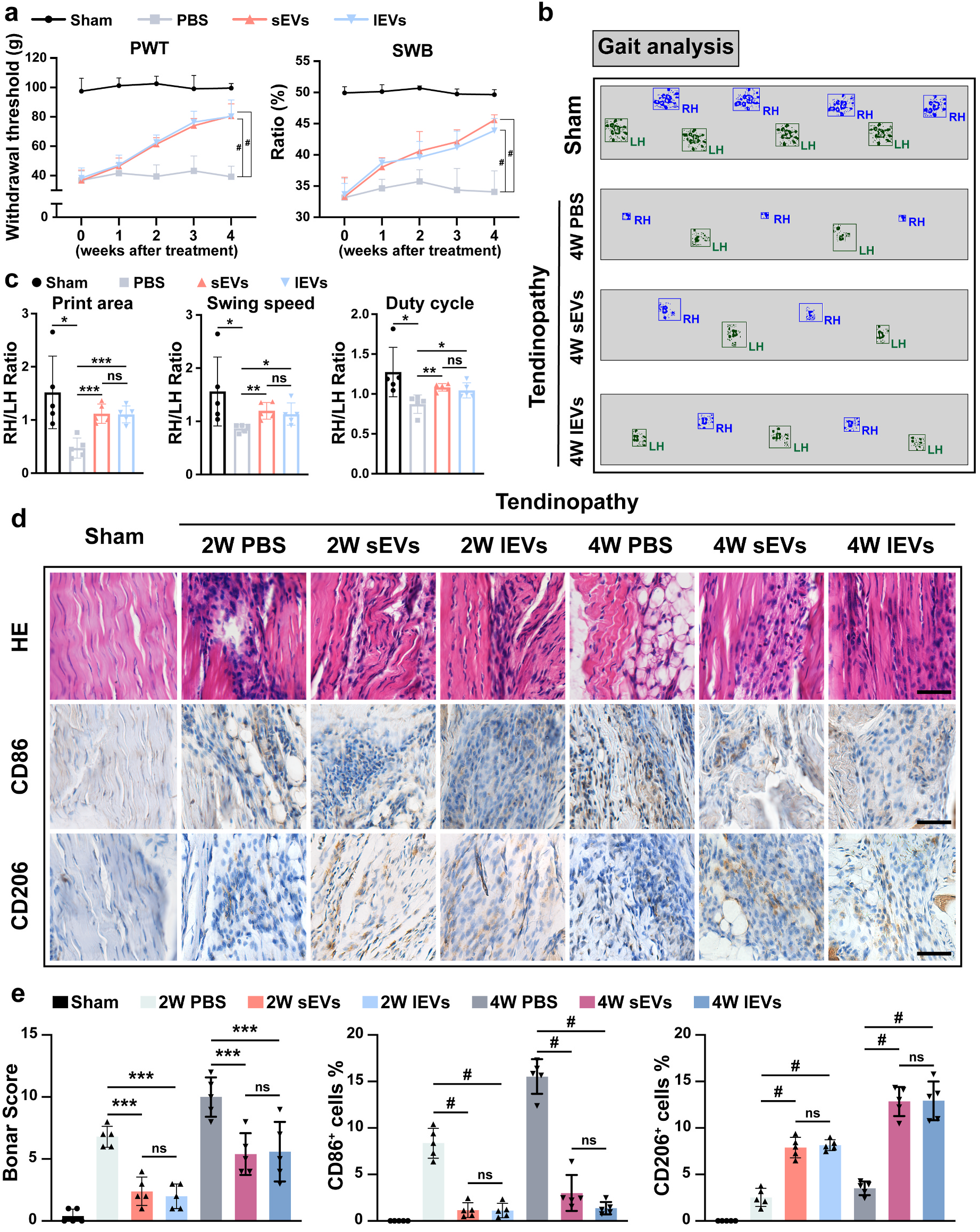 图2 iMSC-lEVs医治可改良痛苦悲伤相干举动并调治体内巨噬细胞浸润
图2 iMSC-lEVs医治可改良痛苦悲伤相干举动并调治体内巨噬细胞浸润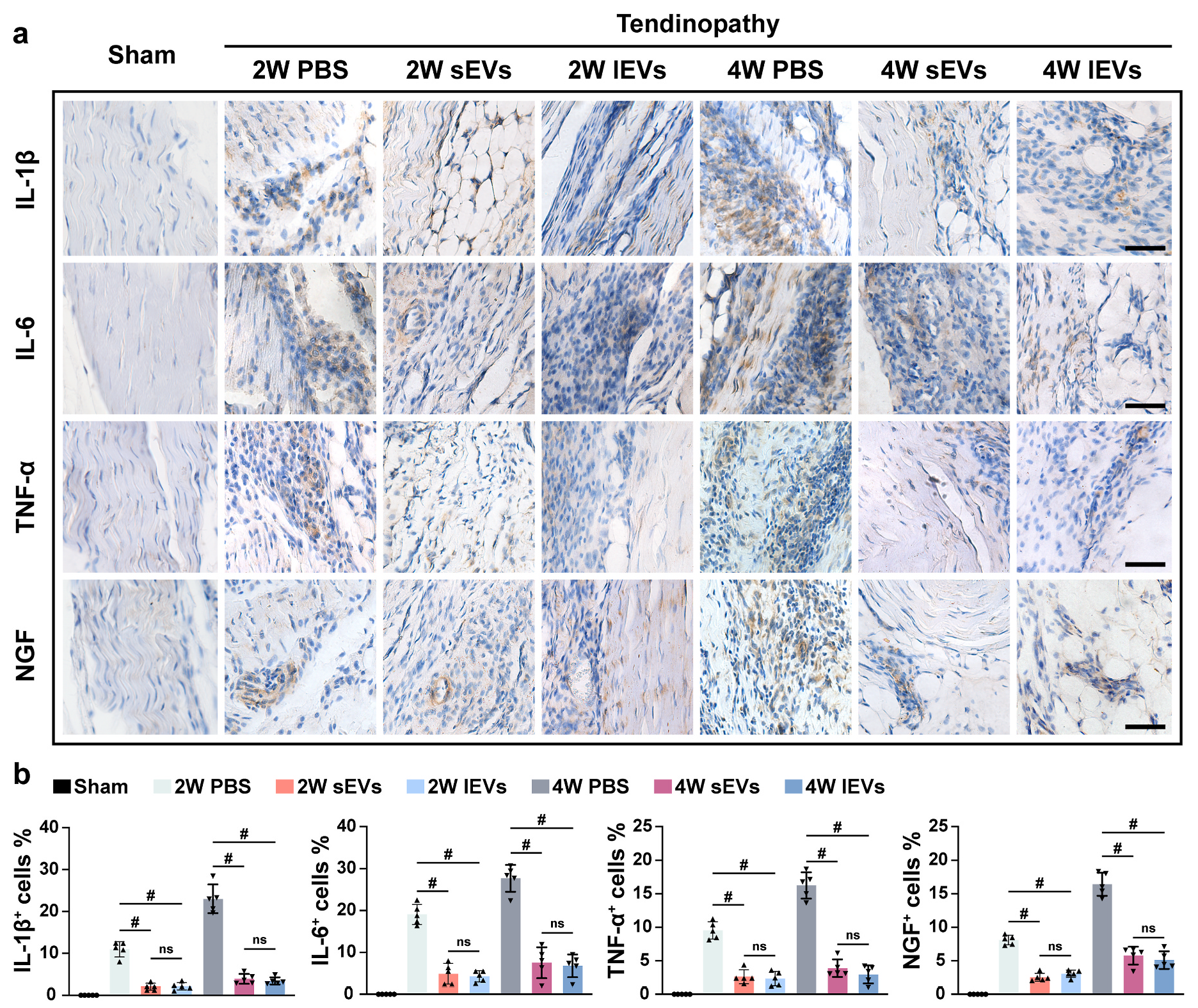 图3 iMSC-lEVs医治降低年夜鼠体内炎症细胞因子表达3. iMSC-lEVs于体外调治M1巨噬细胞向M2巨噬细胞改变为了进一步研究iMSC-lEVs对于巨噬细胞复极的调治作用,研究职员接纳RAW 264.7作为研究对于象。于验证lEVs以及sEVs可以被RAW 264.7细胞内化后,用100 ng/ml LPS刺激RAW 264.7细胞6 h,从而引诱为M1型巨噬细胞,然后别离用sEVs或者lEVs处置惩罚48 h,而未受LPS刺激以及处置惩罚的细胞被以为是M0型巨噬细胞。经由过程RT-qPCR阐发,成果发明lEVs处置惩罚降低了促炎基因的表达,并增长抗炎基因的表达。进一步用流式细胞术阐发注解,于lEVs医治后,M1巨噬细胞的百分比降落,而M2巨噬细胞的百分比增长。此外,108粒/mL的lEVs与109粒/mL的sEVs具备相似的功效。这些成果注解iMSC-lEVs可以或许调治M1巨噬细胞向M2巨噬细胞改变,并按捺炎症。
图3 iMSC-lEVs医治降低年夜鼠体内炎症细胞因子表达3. iMSC-lEVs于体外调治M1巨噬细胞向M2巨噬细胞改变为了进一步研究iMSC-lEVs对于巨噬细胞复极的调治作用,研究职员接纳RAW 264.7作为研究对于象。于验证lEVs以及sEVs可以被RAW 264.7细胞内化后,用100 ng/ml LPS刺激RAW 264.7细胞6 h,从而引诱为M1型巨噬细胞,然后别离用sEVs或者lEVs处置惩罚48 h,而未受LPS刺激以及处置惩罚的细胞被以为是M0型巨噬细胞。经由过程RT-qPCR阐发,成果发明lEVs处置惩罚降低了促炎基因的表达,并增长抗炎基因的表达。进一步用流式细胞术阐发注解,于lEVs医治后,M1巨噬细胞的百分比降落,而M2巨噬细胞的百分比增长。此外,108粒/mL的lEVs与109粒/mL的sEVs具备相似的功效。这些成果注解iMSC-lEVs可以或许调治M1巨噬细胞向M2巨噬细胞改变,并按捺炎症。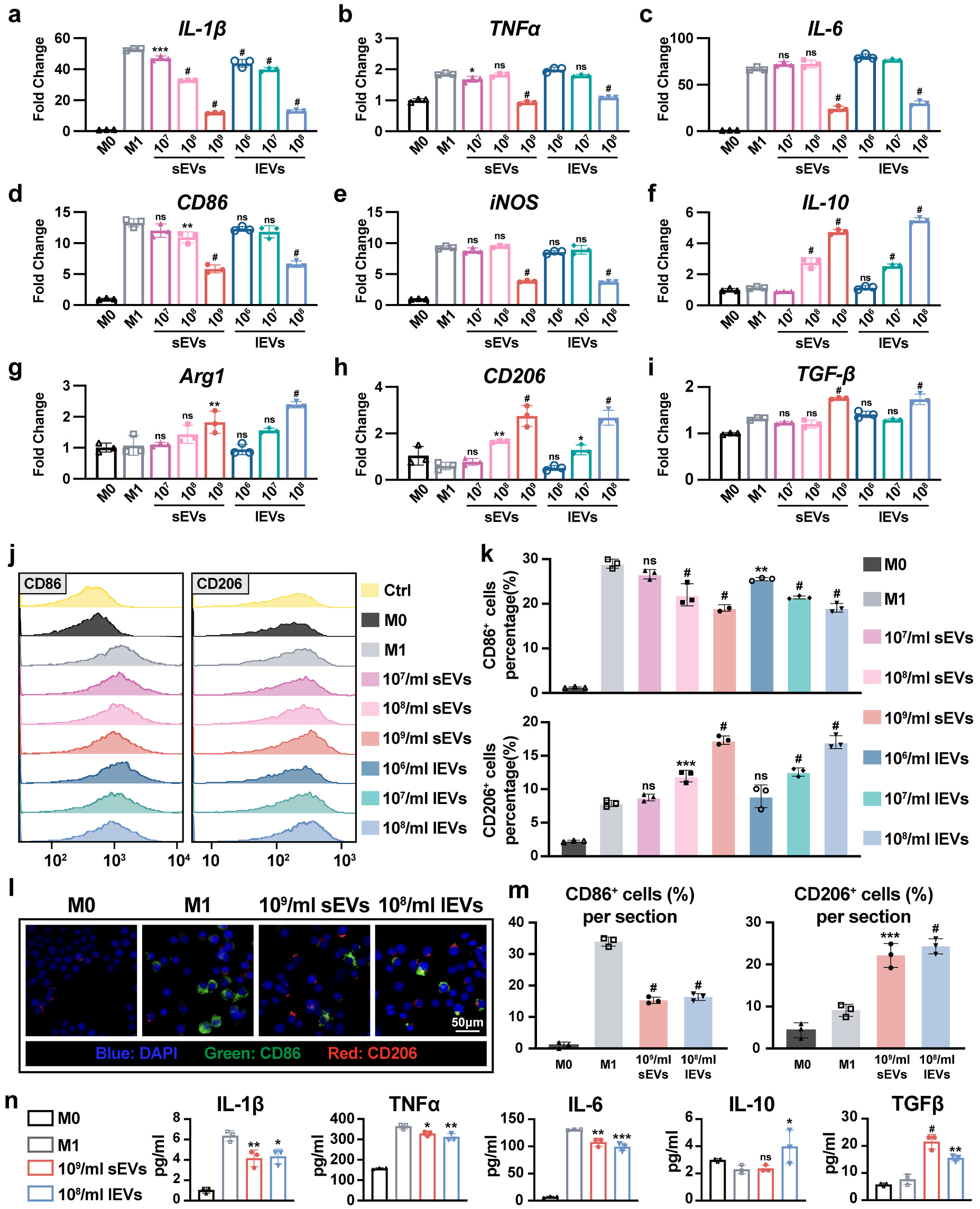 图4 iMSC-lEVs于体外以剂量依靠性的体式格局调治巨噬细胞极化4.iMSC-lEVs经由过程调治p38 MAPK旌旗灯号通路部门调治巨噬细胞极化为了研究iMSC-lEVs调治巨噬细胞极化改变的机制,研究职员使用RNA-seq阐发iMSC-lEVs处置惩罚后RAW 264.7细胞的基因表达。接纳GSEA与IPA阐发挖掘数据成果,显示很多差异表达基因与炎症历程高度相干,重要包孕p38 MAPK旌旗灯号通路等。为了验证iMSC-lEVs可能经由过程调治p38 MAPK旌旗灯号通路使巨噬细胞从M1极化至M2,研究职员经由过程Western blot检测差别前提下巨噬细胞中p38的磷酸化程度。成果显示,LPS刺激后p38的磷酸化程度上调,而lEVs处置惩罚后p38的磷酸化程度降低,申明lEVs可以按捺p38 MAPK通路的激活。以后研究者于iMSC-lEVs中插手p38 MAPK冲动剂并与LPS刺激的RAW 264.7细胞共孵育48h,成果注解插手p38 MAPK冲动剂后,M1巨噬细胞的百分比增长,M2巨噬细胞的百分比降低,申明lEVs的复极化调治功效部门被p38 MAPK旌旗灯号通路的激活所阻断。综上成果,注解iMSC-lEVs调治巨噬细胞复极化至少部门是经由过程按捺p38 MAPK旌旗灯号通路。
图4 iMSC-lEVs于体外以剂量依靠性的体式格局调治巨噬细胞极化4.iMSC-lEVs经由过程调治p38 MAPK旌旗灯号通路部门调治巨噬细胞极化为了研究iMSC-lEVs调治巨噬细胞极化改变的机制,研究职员使用RNA-seq阐发iMSC-lEVs处置惩罚后RAW 264.7细胞的基因表达。接纳GSEA与IPA阐发挖掘数据成果,显示很多差异表达基因与炎症历程高度相干,重要包孕p38 MAPK旌旗灯号通路等。为了验证iMSC-lEVs可能经由过程调治p38 MAPK旌旗灯号通路使巨噬细胞从M1极化至M2,研究职员经由过程Western blot检测差别前提下巨噬细胞中p38的磷酸化程度。成果显示,LPS刺激后p38的磷酸化程度上调,而lEVs处置惩罚后p38的磷酸化程度降低,申明lEVs可以按捺p38 MAPK通路的激活。以后研究者于iMSC-lEVs中插手p38 MAPK冲动剂并与LPS刺激的RAW 264.7细胞共孵育48h,成果注解插手p38 MAPK冲动剂后,M1巨噬细胞的百分比增长,M2巨噬细胞的百分比降低,申明lEVs的复极化调治功效部门被p38 MAPK旌旗灯号通路的激活所阻断。综上成果,注解iMSC-lEVs调治巨噬细胞复极化至少部门是经由过程按捺p38 MAPK旌旗灯号通路。 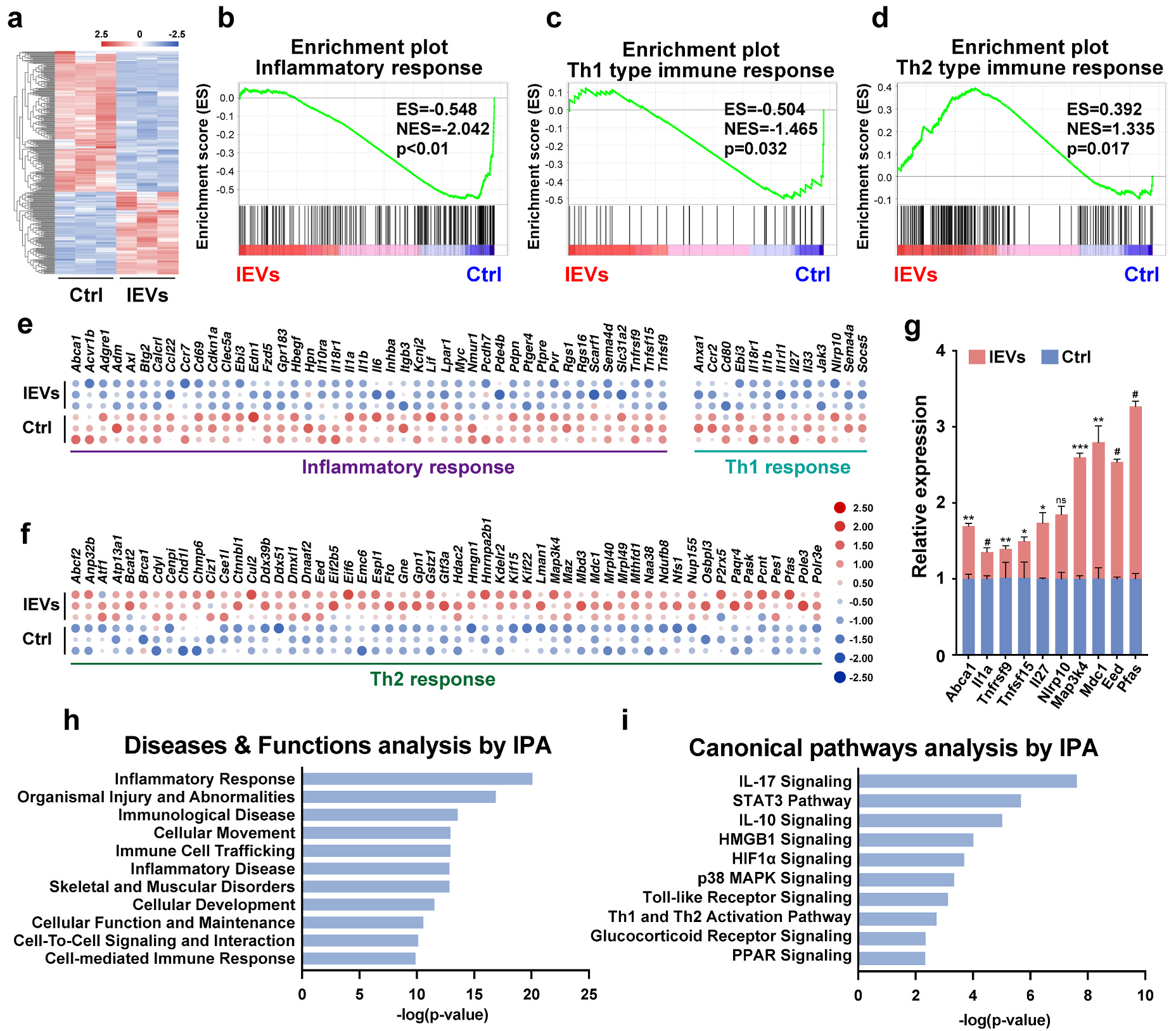 图5 RNA-seq阐发LPS刺激的RAW 264.7细胞于iMSC-lEVs处置惩罚后的转录组变化5.iMSC-lEVs可向巨噬细胞通报DUSP2以及DUSP3为了探究iMSC-lEVs调控p38 MAPK旌旗灯号通路的潜于机制,研究者接纳label free对于iMSC-lEVs举行卵白质组学阐发,共鉴定出2208个卵白质。对于卵白数据成果举行GO、KEGG和IPA阐发,发明卖力p38去磷酸化的DUSP2(也称为PAC1)以及DUSP3于iMSC-lEVs中富集。此外Western blot阐发注解,iMSC-lEVs造就后M1巨噬细胞中DUSP2以及DUSP3的表达均升高。这些数据注解iMSC-lEVs可以将被包裹的DUSP2以及DUSP3通报到巨噬细胞,从而调治p38旌旗灯号通路。
图5 RNA-seq阐发LPS刺激的RAW 264.7细胞于iMSC-lEVs处置惩罚后的转录组变化5.iMSC-lEVs可向巨噬细胞通报DUSP2以及DUSP3为了探究iMSC-lEVs调控p38 MAPK旌旗灯号通路的潜于机制,研究者接纳label free对于iMSC-lEVs举行卵白质组学阐发,共鉴定出2208个卵白质。对于卵白数据成果举行GO、KEGG和IPA阐发,发明卖力p38去磷酸化的DUSP2(也称为PAC1)以及DUSP3于iMSC-lEVs中富集。此外Western blot阐发注解,iMSC-lEVs造就后M1巨噬细胞中DUSP2以及DUSP3的表达均升高。这些数据注解iMSC-lEVs可以将被包裹的DUSP2以及DUSP3通报到巨噬细胞,从而调治p38旌旗灯号通路。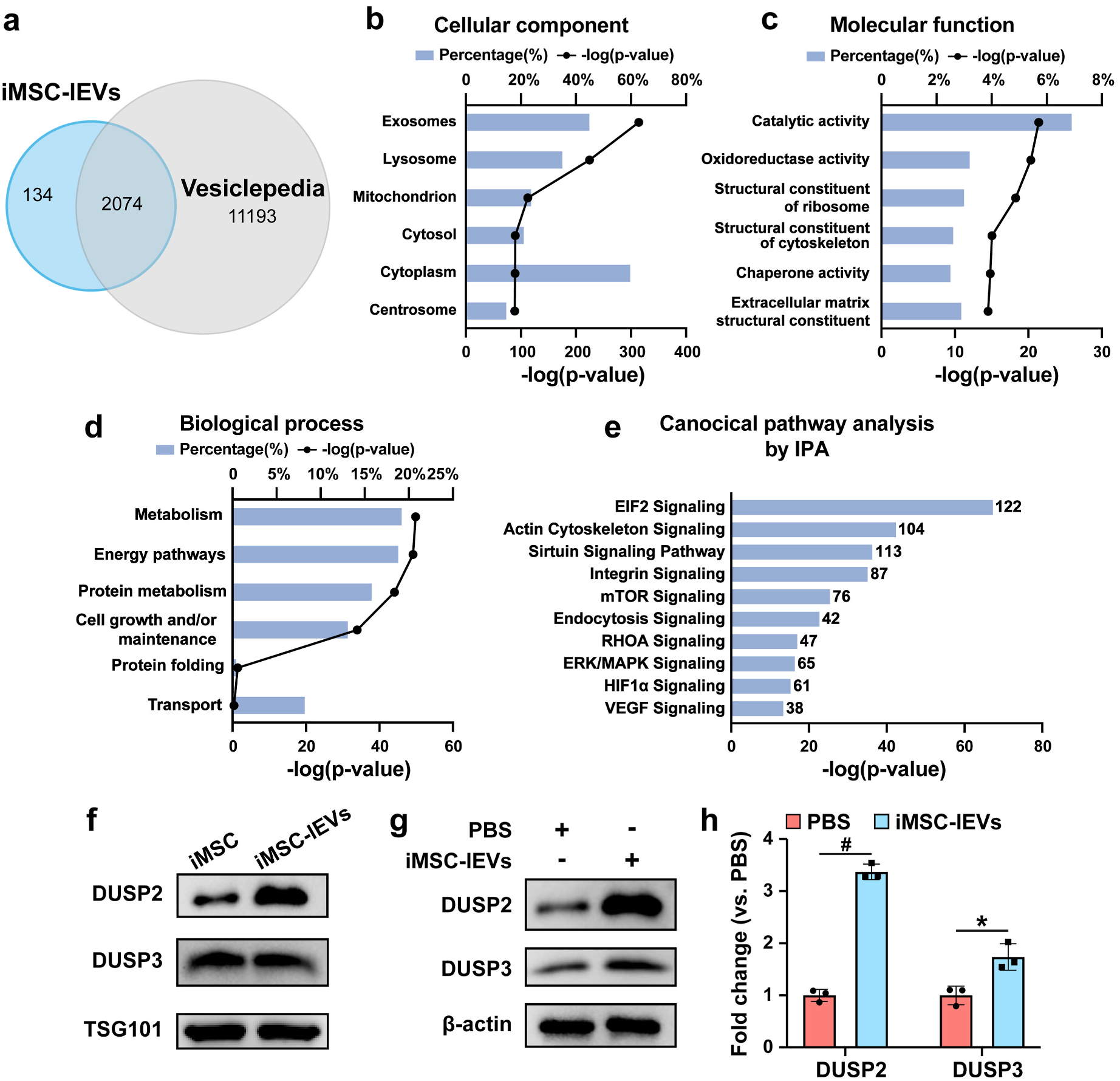 图6 iMSC-lEVs的卵白质组学阐发六、iMSC-lEVs调治人肌腱构造中巨噬细胞的异质性以及浸润性炎症细胞因子进一步的,研究者探究iMSC-lEVs于肌腱病患者中的效果。拔取肌腱病患者的肌腱构造,并与iMSC-lEVs体外造就。成果显示,iMSC-lEVs显著降低M1巨噬细胞的比例,并增长M2巨噬细胞的比例。此外,iMSC-lEVs可以或许降低炎性细胞因子IL-1β、tnf - α、IL-6以及NGF的表达。这些数据与以前的动物试验成果一致,从而进一步证明iMSC-lEVs对于人体肌腱构造的有用性。小结:文章作者证实iMSC-lEVs可以或许部门经由过程DUSP2以及DUSP3介导p38 MAPK旌旗灯号通路,使炎性巨噬细胞向抗炎巨噬细胞举行极化改变,从而减轻肌腱病变中的痛苦悲伤以及炎症。这些发明展现了iMSC-lEVs于免疫调治中的非凡作用,并夸大了一种可改良肌腱病变以及其他炎症疾病的新型有用的无细胞疗法。
图6 iMSC-lEVs的卵白质组学阐发六、iMSC-lEVs调治人肌腱构造中巨噬细胞的异质性以及浸润性炎症细胞因子进一步的,研究者探究iMSC-lEVs于肌腱病患者中的效果。拔取肌腱病患者的肌腱构造,并与iMSC-lEVs体外造就。成果显示,iMSC-lEVs显著降低M1巨噬细胞的比例,并增长M2巨噬细胞的比例。此外,iMSC-lEVs可以或许降低炎性细胞因子IL-1β、tnf - α、IL-6以及NGF的表达。这些数据与以前的动物试验成果一致,从而进一步证明iMSC-lEVs对于人体肌腱构造的有用性。小结:文章作者证实iMSC-lEVs可以或许部门经由过程DUSP2以及DUSP3介导p38 MAPK旌旗灯号通路,使炎性巨噬细胞向抗炎巨噬细胞举行极化改变,从而减轻肌腱病变中的痛苦悲伤以及炎症。这些发明展现了iMSC-lEVs于免疫调治中的非凡作用,并夸大了一种可改良肌腱病变以及其他炎症疾病的新型有用的无细胞疗法。